Le ganglion sentinelle
Les cancers de la peau
Introduction
Les recommandations françaises concernant la prise en charge des mélanomes de stade III ont fait l’objet d’une mise à jour par le Groupe de cancérologie Cutanée (GCC) publiée en 2019 1.
En 2016, le Groupe de Cancérologie Cutanée publiait des recommandations pour la prise en charge du mélanome stade I à III 2. Depuis cette date, les données scientifiques ont considérablement évolué. En effet, les résultats des études sur l’intérêt du curage après mise en évidence d’un ganglion sentinelle positif 3,4 et surtout les résultats des essais adjuvants avec l’immunothérapie 5,6 ou les thérapies ciblées 7 ont été publiés. Une actualisation des recommandations devenait donc nécessaire.
Ces recommandations ont été de nouveau confirmées par la dernière édition des recommandations européennes de prise en charge du mélanome 8.
Recommandations sur la procedure du ganglion sentinelle 1
- Après l’exérèse initiale d’un mélanome primitif cutané, la réalisation de la procédure du ganglion sentinelle est recommandée lorsqu’un traitement adjuvant est envisagé.
- En l’absence de traitement adjuvant envisagé (contre-indication ou refus du malade), la recherche du ganglion sentinelle reste une option, compte-tenu de sa valeur pronostique.
- Avant de procéder à la technique du ganglion sentinelle, il est nécessaire d’éliminer par la clinique et l’imagerie la présence d’une métastase régionale ou à distance selon le stade anatomo-clinique (Classification AJCC 8ème édition) 9.
- Si la procédure de recherche du ganglion sentinelle est retenue :
- Elle est recommandée pour les mélanomes de plus de 1 mm de Breslow sans ganglion identifié (stade T2-T3-T4 AJCC 8ème édition).
- Elle peut être proposée dans les mélanomes de Breslow 0,8 à 1 mm, quel que soit le statut de l’ulcération et les mélanomes de moins de 0,8 mm ulcérés (T1b AJCC 8ème édition).
- Il n’y a pas d’indication à faire la recherche du ganglion sentinelle dans les mélanomes de moins de 0,8 mm de Breslow non ulcérés (stade T1a AJCC 8ème édition).
Objectifs
L’envahissement du ganglion sentinelle est un facteur pronostique indépendant pour la survie spécifique ; l’analyse du ganglion sentinelle permet de préciser le stade du mélanome 8, ce qui est indispensable pour proposer un traitement adjuvant, selon les recommandations actuelles.
Des études multicentriques ont montré que, malgré une faible augmentation de la survie sans récidive chez les patients ayant eu une analyse du ganglion sentinelle, cette procédure n’impacte pas la survie globale 8.
Contre-indications
L’analyse du ganglion sentinelle n’est pas proposée lorsque :
- une radiothérapie a déjà été réalisée au niveau de la zone concernée ;
- une extension loco-régionale ou à distance est mise en évidence au bilan initial ;
- le patient a des comorbidités limitantes par ailleurs.
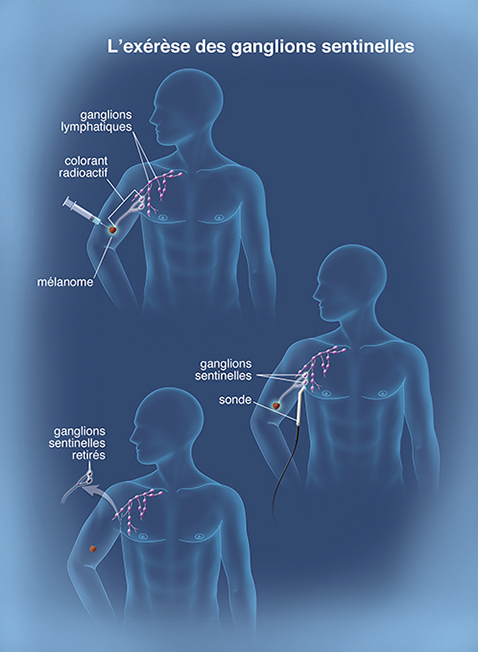
Déroulement de l’exérèse du ganglion sentinelle
L’exérèse du ganglion sentinelle se déroule, en principe, en même temps que la reprise du mélanome primitif, sous anesthésie générale, lors d’une brève hospitalisation ou dans le cadre d’une hospitalisation de jour dans certains cas.
Afin de localiser le ou les ganglion(s) sentinelle(s), un produit de repérage est injecté au voisinage de la cicatrice de l’exérèse initiale du mélanome, après anesthésie locale. Deux produits sont le plus souvent utilisés : le bleu patenté ou un produit radioactif. Parfois, ces deux produits sont associés.
L’injection de la substance radioactive se fait quelques heures avant l’intervention chirurgicale. L’injection de bleu patenté a lieu en salle d’opération, quelques minutes avant la recherche des ganglions.
Le produit de repérage est absorbé par les vaisseaux lymphatiques et circule jusqu’aux premiers ganglions (le ou les ganglion(s) sentinelle(s)) en aval du mélanome.
Lorsque le produit utilisé est une substance radioactive, le ou le(s) ganglion(s) est/sont localisé(s) grâce à une scintigraphie effectuée par un médecin nucléaire avant l’intervention et à une sonde peropératoire utilisée par le chirurgien pendant l’opération, qui permet une localisation précise. S’il a choisi le colorant, le chirurgien recherche, pendant l’intervention, le ou les ganglion(s) sentinelle(s) qui sera/seront alors teinté(s) de bleu.
Dans de rares cas, il arrive que cette procédure ne permette pas de repérer le ou les ganglion(s) sentinelle(s). Dans cette situation, le plus souvent, aucun ganglion n’est alors retiré.
Lorsque le ou les ganglion(s) sont repérés, le chirurgien le/les retire en faisant une incision à l’aplomb du ou des ganglion(s) sentinelle(s). Lors de cette intervention, un à trois ganglions lymphatiques est/sont habituellement enlevé(s).
Résultats de l’analyse du ganglion sentinelle
Si le ou les ganglion(s) sentinelle(s) est/sont négatif(s), le risque que des micrométastases soient présentes dans d'autres ganglions et le risque de récidive du mélanome sont faibles. Une surveillance clinique et/ou paraclinique adaptée au stade est alors proposée 8.
Si le ganglion sentinelle est positif, un traitement adjuvant est proposé. Dans cette situation, il n’y a pas d’indication à faire un curage ganglionnaire immédiat systématique 1,8. Il peut se discuter au cas par cas en Réunion de Concertation Pluridisciplinaire (RCP).
Références bibliographiques :
- New guidelines for stage III melanoma (the French Cutaneous Oncology Group).
Guillot B, Dupuy A, Pracht M, Jeudy G, Hindie E, Desmedt E, Jouary T, Leccia MT.
Ann Dermatol Venereol. 2019 Mar;146(3):204-214. doi: 10.1016/j.annder.2019.01.011. Epub 2019 Mar 2.
- Guidelines for stage I to III melanoma.
Guillot B, Dalac S, Denis M, Dupuy A, Emile JF, De La Fouchardiere A, Hindie E, Jouary T, Lassau N, Mirabel X, Piperno Neumann S, De Raucourt S, Vanwijck R.
Bull Cancer. 2016 Sep;103(9):743-52. doi: 10.1016/j.bulcan.2016.06.002. Epub 2016 Jul 22.
- Completion Dissection or Observation for Sentinel-Node Metastasis in Melanoma.
Faries MB, Thompson JF, Cochran AJ, Andtbacka RH, Mozzillo N, Zager JS, Jahkola T, Bowles TL, Testori A, Beitsch PD, Hoekstra HJ, Moncrieff M, Ingvar C, Wouters MWJM, Sabel MS, Levine EA, Agnese D, Henderson M, Dummer R, Rossi CR, Neves RI, Trocha SD, Wright F, Byrd DR, Matter M, Hsueh E, MacKenzie-Ross A, Johnson DB, Terheyden P, Berger AC, Huston TL, Wayne JD, Smithers BM, Neuman HB, Schneebaum S, Gershenwald JE, Ariyan CE, Desai DC, Jacobs L, McMasters KM, Gesierich A, Hersey P, Bines SD, Kane JM, Barth RJ, McKinnon G, Farma JM, Schultz E, Vidal-Sicart S, Hoefer RA, Lewis JM, Scheri R, Kelley MC, Nieweg OE, Noyes RD, Hoon DSB, Wang HJ, Elashoff DA, Elashoff RM.
N Engl J Med. 2017 Jun 8;376(23):2211-2222. doi: 10.1056/NEJMoa1613210.
- Final Analysis of DeCOG-SLT Trial: No Survival Benefit for Complete Lymph Node Dissection in Patients With Melanoma With Positive Sentinel Node.
Leiter U, Stadler R, Mauch C, Hohenberger W, Brockmeyer NH, Berking C, Sunderkötter C, Kaatz M, Schatton K, Lehmann P, Vogt T, Ulrich J, Herbst R, Gehring W, Simon JC, Keim U, Verver D, Martus P, Garbe C; German Dermatologic Cooperative Oncology Group.
J Clin Oncol. 2019 Nov 10;37(32):3000-3008. doi: 10.1200/JCO.18.02306. Epub 2019 Sep 26
- Adjuvant Nivolumab versus Ipilimumab in Resected Stage III or IV Melanoma
Jeffrey Weber, M.D., Ph.D., Mario Mandala, M.D., Michele Del Vecchio, M.D., Helen J. Gogas, M.D., Ph.D., Ana M. Arance, M.D., Ph.D., C. Lance Cowey, M.D., Stéphane Dalle, M.D., Ph.D., Michael Schenker, M.D., Vanna Chiarion-Sileni, M.D., Ivan Marquez-Rodas, M.D., Ph.D., Jean-Jacques Grob, M.D., Marcus O. Butler, M.D., et al., for the CheckMate 238 Collaborators
N Engl J Med 2017; 377:1824-1835
- Pembrolizumab versus placebo after complete resection of high-risk stage III melanoma: new recurrence-free survival results from the EORTC 1325-MG/Keynote 054 double-blinded phase III trial at three-year median follow-up
Eggermont AM, Blank CU, Mandala` M, Long GV, Atkinson V, Dalle S, et al.. J Clin Oncol 2020;38:10000.
- Adjuvant dabrafenib plus trametinib in stage III BRAF-mutated melanoma.
Long GV, Hauschild A, Santinami M, Atkinson V, Mandala M, Chiarion-Sileni V, et al. N Engl J Med 2017;377:1813e23.
- European consensus-based interdisciplinary guideline for melanoma. Part 2: Treatment - Update 2022
Eur J Cancer. 2022 Jul;170:256-284. doi: 10.1016/j.ejca.2022.04.018. Epub 2022 May 24.
Claus Garbe 1, Teresa Amaral 2, Ketty Peris 3, Axel Hauschild 4, Petr Arenberger 5, Nicole Basset-Seguin 6, Lars Bastholt 7, Veronique Bataille 8, Veronique Del Marmol 9, Brigitte Dréno 10, Maria C Fargnoli 11, Ana-Maria Forsea 12, Jean-Jacques Grob 13, Christoph Hoeller 14, Roland Kaufmann 15, Nicole Kelleners-Smeets 16, Aimilios Lallas 17, Celeste Lebbé 6, Bodhan Lytvynenko 18, Josep Malvehy 19, David Moreno-Ramirez 20, Paul Nathan 21, Giovanni Pellacani 22, Philippe Saiag 23, Alexander J Stratigos 24, Alexander C J Van Akkooi 25, Ricardo Vieira 26, Iris Zalaudek 27, Paul Lorigan 28, European Dermatology Forum (EDF), the European Association of Dermato-Oncology (EADO), and the European Organization for Research and Treatment of Cancer (EORTC)
Affiliations expand
PMID: 35623961 DOI: 10.1016/j.ejca.2022.04.018
- Melanoma staging: Evidence-based changes in the American Joint Committee on Cancer eighth edition cancer staging manual.
Gershenwald JE, Scolyer RA, Hess KR, Sondak VK, Long GV, Ross MI, Lazar AJ, Faries MB, Kirkwood JM, McArthur GA, Haydu LE, Eggermont AMM, Flaherty KT, Balch CM, Thompson JF; for members of the American Joint Committee on Cancer Melanoma Expert Panel and the International Melanoma Database and Discovery Platform.
CA Cancer J Clin. 2017 Nov;67(6):472-492. doi: 10.3322/caac.21409. Epub 2017 Oct 13.
